写意报告丨医疗3D打印技术 505(b)(2)路径下产品开发的新机遇与技术挑战
随着增材制造技术的飞速发展,医疗3D打印已从概念探索步入商业化应用深水区。在这一进程中,美国FDA的505(b)(2)新药申请路径,为基于已有获批产品的改良型医疗器械与药物-器械组合产品开发,开辟了一条极具潜力的创新通道。本报告旨在探讨3D打印技术如何与505(b)(2)路径深度融合,为医疗产品开发带来结构性新机遇,并剖析其背后的关键技术开发方向。
一、 505(b)(2)路径:嫁接已知与未知的创新桥梁
505(b)(2)路径允许申办方依靠并非由自身开展的研究数据,来支持其新药或组合产品的安全性与有效性。其核心在于对已获批产品(“参考产品”)进行改良,例如改变剂型、剂量、给药途径,或增加新适应症、开发复方制剂等。对于医疗3D打印领域,这一路径的价值尤为凸显:
1. 降低开发风险与成本:无需从零开始进行全面的临床前与临床研究,可大幅缩短开发周期,加速产品上市。
2. 聚焦高价值改良:企业可将资源集中于利用3D打印技术实现的关键性能提升,如个性化匹配、复杂结构制造、控释给药等。
3. 拓展产品生命周期:为成熟的“老药”或经典器械植入物赋予新的技术内涵与市场竞争力。
二、 3D打印技术驱动的505(b)(2)产品新机遇
结合3D打印的技术特性,在505(b)(2)框架下,以下几类产品开发迎来爆发性机遇:
1. 个性化植入物与手术导板
机遇:基于患者CT/MRI数据,打印完全贴合解剖结构的颅颌面骨板、脊柱融合器、关节植入物等。这属于对已获批标准化植入物的“给药途径/使用方式”的深度个性化改良。
技术开发焦点:生物力学优化算法、医用级金属(钛合金、钽)与高分子(PEEK)材料的打印工艺验证、术后长期随访数据的积累以证明个性化设计的优越性。
2. 复杂结构的药物洗脱器械
机遇:制造传统工艺无法实现的、具有复杂多孔或网格结构的药物洗脱支架、骨填充物或软组织修复膜。通过精准控制孔隙率和结构,优化药物的负载与释放动力学。
技术开发焦点:药物与可打印生物材料的相容性、打印过程对药物活性的影响、体外释放与体内药代/药效的桥接研究。
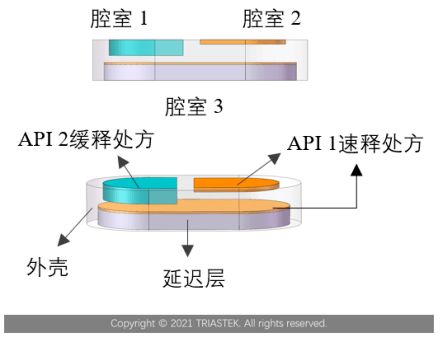
3. 个性化剂型与给药装置
机遇:打印具备特定形状、大小、内部结构和多药物分区的口服片剂(多单元递送系统),或定制化的皮下植入物、宫内器械等。这是对剂型、剂量和释放行为的革命性改变。
技术开发焦点:适用于熔融沉积成型(FDM)或立体光固化(SLA)的药用辅料开发、打印工艺的过程分析技术(PAT)与质量控制、体内外相关性(IVIVC)研究模型的建立。
4. 组织工程支架与先进治疗产品(ATMPs)
机遇:打印承载细胞或生长因子的生物活性支架,用于软骨、皮肤等组织再生。这类产品可能介于器械、生物制品与组合产品之间,505(b)(2)路径可借鉴已有生物材料或生长因子的安全数据。
技术开发焦点:生物墨水的开发与标准化、打印后细胞活力与功能维持、规模化生产的无菌保证。
三、 关键技术开发挑战与应对策略
尽管机遇巨大,但技术开发路径上布满挑战,需要系统性攻关:
1. 材料科学与法规
医用3D打印材料(特别是聚合物和复合材料)的长期生物相容性、降解行为、灭菌稳定性数据尚不完善。开发需与USP Class VI等生物相容性标准以及材料化学、制造与控制(CMC)要求紧密结合。
2. 工艺验证与质量保证
3D打印是一个逐层构建的过程,工艺参数(如层厚、温度、扫描路径)对产品关键质量属性(CQA)影响巨大。必须建立从数字模型到最终产品的全过程验证体系,并实施严格的批次间一致性控制。
3. 设计工具与软件认证
用于生成打印文件的医学图像处理与设计软件,其算法可靠性直接影响患者安全。这类软件作为医疗设备的一部分,其开发流程需符合医疗器械软件(SaMD)的监管要求。
4. 临床证据生成策略
在505(b)(2)路径下,需要科学论证3D打印改良相较于参考产品的“相似性”与“优越性”。这要求设计巧妙的临床终点,可能包括解剖匹配度、手术时间、患者特异性功能恢复等,而非传统的统一样本统计。
四、 结论与展望
医疗3D打印与505(b)(2)监管路径的结合,正催生一个以“精准”和“个性化”为核心的医疗产品开发新范式。成功的关键在于跨学科深度融合——工程师、材料学家、药理学家和临床医生必须与法规事务专家早期协作,共同定义产品属性和开发策略。
随着材料数据库的扩充、打印工艺的标准化、以及监管科学对个性化产品评价体系的逐步完善,基于3D打印的505(b)(2)产品有望从当前的骨科、齿科,快速拓展至心血管、神经、肿瘤治疗等多个高价值领域,最终实现从“批量生产”到“精准创造”的医疗制造革命。企业若能率先攻克上述技术开发难关,并娴熟运用505(b)(2)策略,必将在这场变革中占据制高点。
如若转载,请注明出处:http://www.maihekejixcx.com/product/58.html
更新时间:2026-01-13 02:08:55